デング―Review
Wilder-Smith A, et al. Lancet 2019;393:350 Seminar
Introduction
●デング熱は節足動物媒介arthropod-borneのウイルス性疾患で、熱帯・亜熱帯地域に大きな疾病負荷disease burdenを強いている。Arbovirus疾患として最も頻度の高い疾患である。
※アルボウイルス:節足動物の吸血活動で伝播するウイルスの総称。ジカ、黄熱、日本脳炎、SFTS、チクングニアなど。
●The Global Burden Disease studyによると、2000-2013年の13年間に400%の増加がみられ、これは感染性疾患として最も高い増加率である。
Epidemiology and drivers for the geographic expansion of dengue
●シマカAedesがデングを媒介する。Aedesの生息地域には30億人が居住している。年間のデングウイルス感染症発生数は4億件と推定され、うち25%がclinically apparent、障害調整生命年disability-adjusted life years (DALYs)は110万に相当する。世界のdisease burdenの75%がアジア。次にラテンアメリカ・アフリカである。
●endemic areasでは、発熱エピソードの10%にも達する。アジアでは100人年あたり4.6、ラテンアメリカでは2.9。病院での治療を要するデングによる発熱エピソードはアジアでは19%、ラテンアメリカでは11%。
●ネッタイシマカAedes aegyptiは昼行性diurnalでヒトの居住地近くに多く出没する。短時間で複数回ヒトを吸血でき、小さな水場でも繁殖が可能である。ヒトスジシマカAedes albopictusは熱帯地域から温帯地域まで生息域を広げつつある。
●温暖化によりAedesの生息域が広がれば、デングは温帯地方でも流行する可能性がある。といっても、デングの発生・流行にとってカの生息域以上に重要なのは、人口増加および人口密度、環境である。都市部への人口流入、都市部の環境悪化、水道の未整備、カ対策の不備など。
●交通機関の影響は大きい。アメリカでは何年も前から、輸入デングをきっかけとした小規模のdisease clustersが発生しているが、ヨーロッパで発生したautochthonous sporadicな症例は2010年にやっと報告されている(フランスとクロアチア)。また2012年にmajor outbreakがポルトガル領マデイラ諸島で報告された。
●ウイルス血症の旅行者がnon-endemic areasを訪れた際に、autochthonousな感染のmain sourceになりやすい。海外旅行者のデングのリスクは増しており、attack ratesは1000 travel-monthsあたり5.51との報告がある(Peace Corpsの研究)。東南アジア帰りの熱性疾患としてはマラリアを上回っている。
The Virus
●デングウイルス(DENV)はgenus Flavivirus, family Flaviviridaeに属する。血清学的かつ遺伝学的に4つのセロタイプに分類される。
●DENVはエンベロープがあり、single positive-strand RNA genomeを持ったウイルスで、3つの構造蛋白(capsid [C], pre-membrane [prM], envelope [E])と、7つの非構造蛋白(NS1, NS2A, NS2B, NS3, NS4A, NS4B, NS5)をコードする。C蛋白がgenomeを囲み、それがlipid layer membraneに包まれる。MembraneにE蛋白、M蛋白が埋め込まれている。E蛋白が、宿主のsusceptible細胞のレセプターに結合し、中和抗体のエピトープとなる。NS1、NS5はreplication complexを形成し、ウイルスゲノムの増幅に関与する。
Pathogenesis of severe dengue
Antibody-dependent enhancement
●DENVの4つのセロタイプは共通する構造蛋白も多く、あるセロタイプのDENVに感染すると、「type-specificな抗体」と「cross-reactiveな抗体」の両方がinduceされる。Homologous virus(=かかったセロタイプ)については長期間適応免疫が続くが、heterologous virus(かかっていないセロタイプ)の免疫は短期間で切れる(3ヶ月、2年といった報告あり)。
●2度目のデングで、最初のウイルスとはheteroなウイルスに感染した際、severe dengueのリスクが上がる現象が知られる(Antibody-dependent enhancement (ADE))。cross-reactiveな抗体や(初めにかかったセロタイプに対する抗体)、sub-neutralisingレベルの抗体(少ない量の抗体)がウイルスのホスト細胞への侵入を促進するというものである。これには標的細胞(単球、マクロファージ、dendritic cells)のFcレセプターが関与している(抗体+ウイルスがFcレセプターと結合するが、この過程でウイルスの細胞への侵入を許してしまう?)。ホストの抗ウイルス免疫応答から逃れることにも働くらしい。実際、二度目の感染患者では、ウイルス血症やNS抗原血症も高度である。
●ニカラグアの報告で、小児のsevere dengueのリスクはseropositiveで必ずしも上がるわけではなく、低すぎてもダメらしい。この現象はFcレセプターの性質からくるものかもしれない。抗体とウイルスが結合したaggregatesによって複数のFcレセプターがco-ligateし活性化する。抗体の量が少ないと、抗体と結合したDENVは、相対的に多いactivating Fcレセプターとco-ligateする(=ADEを起こすほどの侵入レベルには至らない)。抗体の量が多いと、ウイルスaggregateは大きくなり、抑制性Fcγレセプター(FcγRIIB)とco-ligateするが、このレセプターはphagocytosisを抑制するので、ウイルスの細胞へのエントリーが抑制される。したがってADEはつねに起きるわけではなく、特定の抗体・ウイルスの比が必要(少なすぎてもダメだし、多すぎてもダメ)。
●reactive non-neutralising immunogloburin Gの存在するときだけ重症化しやすいことになり、IgGのtitresだけみても重症化を予測できない。
Viral determinants
●プエルトリコでの1994年のアウトブレイクの際にシークエンスされたDENV-2のエンベロープ遺伝子は、1982年にアウトブレイクしたものと比較し、コドンがいくつか変化していた。またSantiago de Cubaの1997年のDENV-2 epidemicでは、それ以前のepidemicしたものと比較し、NS1抗原のアミノ酸一つが変化していた。Sri Lankaでの2000年と1989年のDENV-3によるdengue haemorrhagic feverのアウトブレイクも、遺伝学的な変異により生じたものと考えられている。
●他のRNAウイルスほどの速さではないが、DENVもerror-prone RNA-dependent RNA polymeraseにより、頻繁に変異する。ホストの抗ウイルス反応から逃れやすいウイルスほど、定着しやすい。臨床的、疫学的にフィットしやすいDENVのviral determinantsの研究が必要である。
●デングの病原性に最も関与していると言われるのがNS1抗原である。NS1はreplication complexを構成する成分で、endoplasmic reticulumの中にdimerとして存在する。ホストの様々なタンパクと結合する。Hexameric formのNS1は感染細胞の外へ放出され、補体やレクチンによる中和からウイルスが逃れる手助けをするなど様々な機能を発揮する。そのほかに、内皮のglycocalyxを阻害する働きもあり、vascular leakageの原因となる。さらに、カのmidgutにおいて、感染を妨げるreactive oxygen species responseを阻害する働きもある。
Host factors
●様々なホスト側の因子も確認されている。FcγRIIA、サイトカイン、HLAなど。
Transmission
●雌のカの吸血によってtransmitされる。輸血、臓器移植、針刺し、粘液の飛び散りでの感染もありうる。
●Zika virusとは違って、性交渉での感染は報告されていない。長期間精液中からウイルスがshedしたという一例報告があるが、一方で5人の患者で精液のPCRは陰性であったという報告もある。膣分泌液では、発症後18日間にわたってRNAが検出されたという報告あり。
●分娩時に、母親にウイルス血症があれば垂直感染しうる。経胎盤感染は確認されていない。12人のデングの授乳婦で75%の母乳からウイルスをretrieveしたという報告があり、授乳による感染はplausibleだが報告はない。
Clinical manifestations
Disease classification
●DENV感染症患者の半数以上は無症状もしくはvery minor symptomsのみ。
●感染者の25%がself-limitedな発熱をきたし、軽度の血液学的・生化学的異常を示す。
●少数の患者が、systemic vascular leak syndrome、出血を伴いうる凝固異常、臓器障害(特に肝障害、神経障害)など合併症をきたす。
●1997年のWHO分類では、DENV感染症は臨床的にデング熱dengue fever(DF)とデング出血熱dengue haemorrhagic fever(DHF)に分けていた。DHFは重症度に応じてgrade1-4に分かれ、grade3-4がショックを伴いdengue shock syndrome(DSS)と呼ばれる。現在ではこの分類はquestionedである。
●2009年のWHO分類では、症候性だがno major complicationsの患者をdengue、3種の合併症(①dengue shock syndromeまたはrespiratory distressをきたしたplasma leakage、②severe bleeding、③severe organ impairment)のいずれかを伴う患者をsevere dengueとした。この分類はdynamicで、効果的なトリアージと臨床マネジメントを可能とし、疫学的なデータの質を高めると考えられるが、依然controversialではある。
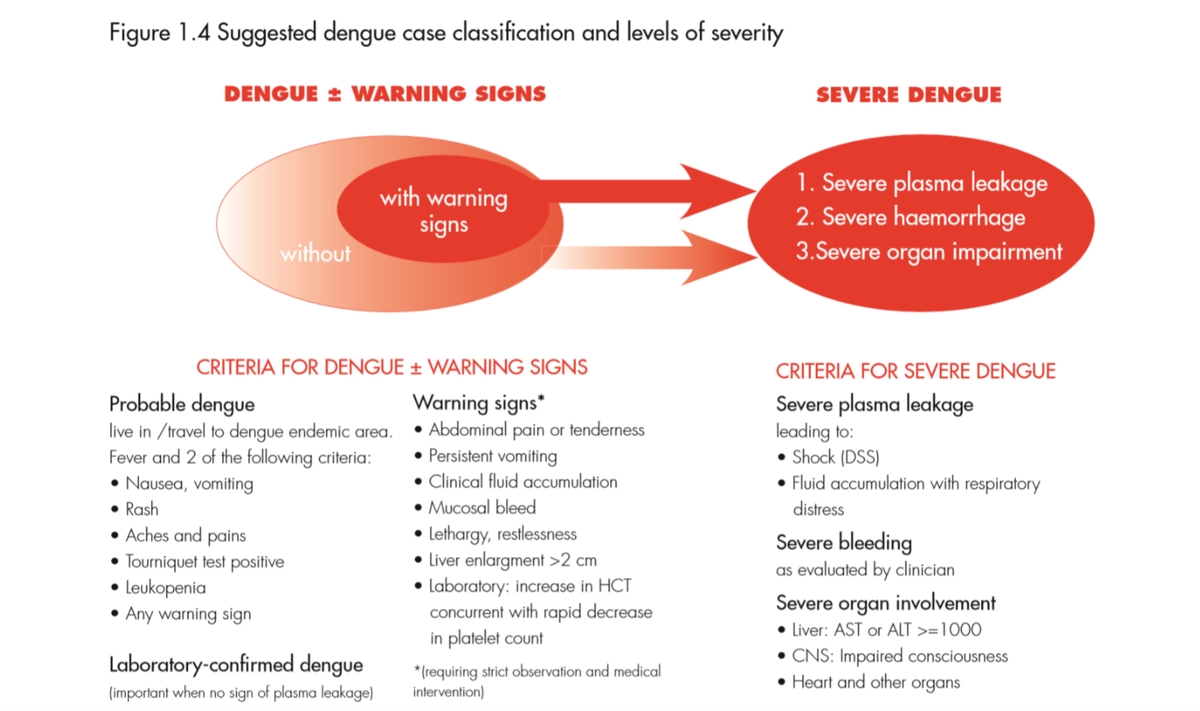
(FigureはWHO dengue guidelines 2009より)
Risk groups
- 流行地域では、dengueは小児・若年成人の疾患である。これは暴露のタイミングの問題と考えられる。
- 新生児はdengue/severe dengueのリスク因子。特にデングに免疫のある母から生まれ、経胎盤的な抗デング抗体がsub-neutralising titresまで弱まった新生児ではリスクが高い。
- 妊婦、特にthird trimester(28-40週)の妊婦もsevere dengueのハイリスクである。周産期の新生児へのtransmissionも確認されている。ブラジルでの2つの大規模疫学研究によると、妊婦のdengueは早産や胎児死亡のリスクを上げるが、先天奇形や低出生体重児のリスクは上げない。
- 流行が比較的少ない地域では、小児よりも成人が発症しやすく、高齢者の割合が増える。併存疾患の影響だろう。
Clinical phases
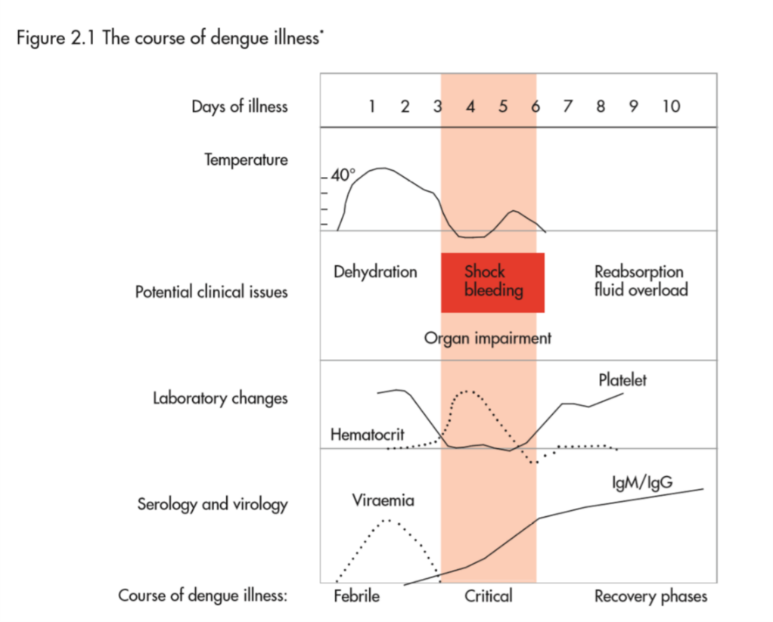
(FigureはWHO dengue guidelines 2009より)
- 潜伏期は4-7日(最大14日)で、突然の発症と、以降3つのphases(febrile、critical、recovery)がみられる。
- Febrile phaseは突然の発熱と悪寒で、頭痛、眼の奥の痛み、筋肉痛、骨の痛み、severe malaise、vomiting、constitutional symptomsを伴う。上気道症状は少ない。小児より成人のほうが、症状が強いことが多い。小児では熱性けいれんあり。発熱は通常3-7日続く。顔面・体幹の潮紅flushingがday 2-3の時期に出現し、一過性にmacular rashもみられる。
- critical phase:多くの患者はfebrile phaseのみで治癒するが、様々な合併症が解熱のタイミング(発症4-6日目)でみられることが重要である。注意が必要なのがvasculopathyで、明確な定義はないがplasma leakage、intravascular volume depletionがみられ、dengue shock syndromeに進展する。ヘマトクリットをみて、血漿濃度が20%以上上昇した場合は漏出の証拠としてよいが、事前のヘマトクリット値がないことが多い。胸水、腹水、心嚢水の貯留は重要な所見だが、ショックとなる前に確認することは難しい。エコーを用いた研究で、発熱のday 2-3には、minor leakageの所見がすでに得られるケースもあると報告されている。
- volume depletionで重要なのは、拡張期血圧の上昇(脈圧の低下)で、脈圧≦20mmHgでdengue shockとする古典的な基準もある。脈圧が低下しても、患者の全身状態は変わらないことが多いが、悪化の明確なサインであり、見逃してはいけない。さらに低血圧・ショックへと進む。
- vasculopathyがいったん改善した48-72h後に再度悪化すること(reshock)もあり、死亡と関連する。
- 小児、高齢者、妊婦、ベースの高血圧、血管障害患者は、ショックの徴候が乏しいことがあるので注意。
- clitical phaseにおける出血徴候はまれではないが通常はminor。Petechiae、epistaxis、鼻出血、軽度の消化管出血など。重篤な消化管出血はまれで、あったとしてもterminal eventである。月経過多による出血はありうる。頭蓋内出血はまれだが致死的。ベースの肝障害、消化性潰瘍、胃炎、抗血栓薬などは出血に影響する。
- 肝:無症状の肝腫大とmild-to-moderateなトランスアミナーゼ上昇transaminitisはvery commonだが、急性肝障害はrare。
- 神経:脳症、脳炎、ニューロパチー、ギランバレー、横断性脊髄炎など。
- 心:心筋障害、特にリズム異常が報告されている(minorまたは無症状の不整脈はcommon)。
- 眼:網膜出血、網膜浮腫、黄斑虚血、視神経炎などが報告あり。
- 腎:顕微鏡的血尿はdengueの20-30%でみられる。Profound DSS、rhabdomyolysisではAKI。
- recovery phase:合併症をきたしても、適格な治療により1-2週でfull recoverする。血管透過性亢進も臨床的に明らかとなってから48-72hでresolveする。回復期にみられるflorid rashは数週続くことがある。成人では、完全な回復まで時間がかかることがあり、倦怠感、体力低下、筋肉痛、抑うつが数週から数ヶ月続くかもしれない。10日以上続く発熱は、細菌感染や二次性のhaemophagocytic lymphohistiocytosisなどを示唆する。
Laboratory investigations
- 血小板減少、白血球減少はfebrile phaseにおいてほぼ全例にみられる。異型リンパ球もoften。ほかの発熱性疾患との区別に有用である。白血球減少の程度はsevere dengue、二次性細菌感染、死亡リスクとは関連がない。抗菌薬の予防投与は推奨されない。
- APTT延長、フィブリノゲン低下は多い。
- トランスアミナーゼはほとんどの症例で上昇。ASTのほうがALTより高く、肝臓だけでなく骨格筋の影響も考えられる。
- TP、Albも低下する。Plasma leakageのマーカーとなるが、血液濃縮によってマスクされる。
- ショックや急性尿細管壊死を伴えばAKI。
Risk prediction
- WHOによってimpending deteriorationの徴候が示されているが、多くは主観的なものでエビデンスも乏しい。
- 7544人のデング疑い小児で、のちにsevere dengueを発症した117人をうまくidentifyするようなアルゴリズムの報告があり、day 3のデータを用いたものであった(Clin Infect Dis 2017;64:656)。
- 毎日血小板数を測り、DSSを予想するモデルの報告もある(PLoS Negl Trop Dis 2017;11:e0005498)
- その他、重症化を予測する様々なバイオマーカーが考案されている。
Diagnosis
- day 5までは、virus isolation in cell culture、RT-PCRなどの核酸増幅検査によるウイルスRNAの検出、ELISAや迅速検査によるウイルス抗原の検出(NS1など)がある。Day 4-5以降は、ウイルスは血中からいなくなるが、NS1はしばらく残る。初回の感染だと残りやすい。
- IgMはday 4頃から上がり始め、days 10-14にピークとなる。3ヶ月以降は消失する。IgGは初回感染では、day 10頃からゆったりと上昇を始め、生涯陽性となる。2回目以降のデング、またはほかのフラビウイルス感染症の既往がある場合は、初めの週に急激に上昇を始める。血清検査ではセロタイプはわからないし、他のフラビウイルス感染とも交差する。また通常ペア血清(acute and convalescent)が必要。
- NS1抗原、IgM抗体の迅速検査は、ラボでのELISAより感度・特異度とも低いとされるが、このpoint of care testingのおかげでdiagnostic windowが広くなり、デング診断にとって画期的な検査である。
- すべての血清検査、NS1抗原検査はZika virusと交差すると報告あり。
Management
- ウイルス特異的な治療薬は主たる研究対象である。もしウイルス血症の程度が重症化のリスクなら、抗ウイルス薬を早期に開始することで、罹病期間を短縮したり重症化を抑制できたりするだろう。transmissionも減らせるかもしれない。Chloroquine、balapiravir、celgosivir、lovastatinなどがRCTで検討されたが、ウイルス血症や重症化抑制に有効であるとのエビデンスは得られなかった(Table)。Ivermectinの試験も実施中である。これまで実施された試験はすべて、治療薬が発症48-72時間の間に投与されており、もしかしたらもっと早く投与する必要があるのかもしれない。
- ウイルスエントリーに関与する小分子薬の開発が行われており、例えばNS4B抗原の阻害薬が開発中。ほかに、ウイルス複製を阻害するモノクローナル抗体などもある。
- ステロイドについては、1980年代の小規模スタディではdengue shock syndromeのmortalityに対する有用性は示されなかった。比較的最近の報告(Clin Infect Dis 2012;55:1216)では、ステロイドによってウイルスのクリアランスが遅れることはないが、ショックやその他合併症を抑制することもできなかったとしている。ただし投与時期や用量の問題かもしれない。コクランレビューではステロイドの有用性はinsufficient evidenceとしている。
- 現状ではsupportive careしかない。vasculopathyが改善するまでの48-72時間は適切な血管内ボリュームを維持する。オーバーロードにも注意。
- 小児のmoderately severe dengueの初期蘇生としてcrystalloidはcolloidと同等に効果があるという報告(NEJM 2005;353:877)がある。reshockの適切な治療は不明。WHOガイドラインでは、expert opinionとしてcolloid bolusesもrecommendしているが、colloidはボリューム負荷の方法としては一般的にappropriateとは考えられていない。
- 血小板輸血もcontroversialである。アジアの成人での検討で(Lancet 2017;389:1611)、20000/µL以下の血小板数で予防的に血小板輸血を行っても出血の予防にはつながらず、かえって副作用が多かった。
- 出血の予防について様々な薬剤が検討されているが(plasma infusion、recombinant activated factor VII、anti-D globulin、immunoglobulin、interleukin 11)、有効なものは見出されていない。
Vector control
- dengueのmortality、morbidity低下につながる。Biologicalな方法は、Bacillus thuringiensis israelensis、larvivorous fish、copepodsなどを用いて、カのlarval stage(=ボウフラ)をコントロールしようとするもの。Cheimicalな方法としては、殺虫剤insecticidesの噴霧や、temephosやpyriproxyfenを用いたlarval stageのコントロール。Environmentalな方法とはカの繁殖場所を減らすことである。
- BMJ 2015;351:h3267は、community mobilisation(= is a process through which action is stimulated by a community itself, or by others, that is planned, carried out, and evaluated by a community's individuals, groups, and organizations on a participatory and sustained basis to improve the health, hygiene and education levels so as to enhance the overall standard of living in the community; wikipediaより)がベクターコントロールに有効で、かつdengueの発生も抑制したと、多施設RCTで示した。
- カからの防護策の徹底はchallenging。カによる虫刺されを十分予防している旅行者も少ない。
- メタアナでhouse screening、水場にカバーをかけること(community-based environmental management with water container covers)はdengueのリスクを下げることが示されたが、屋内での殺虫剤噴霧はリスクを下げなかった。
- 殺虫剤を含有した衣服も期待されているが、学校制服にpermethrinを練りこんだタイの研究(PLoS Negl Trop Dis 2017;11:e0005197)では効果が見られなかった。
- A aegyptiのコントロールで注目されているのは、Wolbachiaを感染させたカをreleaseする方法である(Release of Insects carrying Dominant Lethal genes (RIDL) )。Wolbachia感染は、inherited endosymbiotic bacteriaを用いて、カをアルボウイルス耐性とし、ベクターとして働けなくさせる戦略である。A aegyptiのgenomeにlethal geneを挿入する。
Vaccines
- 2015年に最初のデングワクチンであるサノフィのCYD-TDV(Dengvaxia)が承認された(J Infect Dis 2016;214:1796)。リコンビナント、弱毒生、tetravalent。黄熱17Dウイルスベクターの構造蛋白(preM-E)を4つのDENVの構造蛋白に置き換えたもの。現在20か国で登録されており、通常9-45歳で接種する。phase 3 trial(アジア:Lancet 2014;384:1358、ラテンアメリカ:NEJM 2015;372:113)では、予測していなかったcomplexity、すなわちセロタイプ、ベースのserostatus、年齢によって効果に差があることが示された.(TableはLancet 2014;384:1358より)
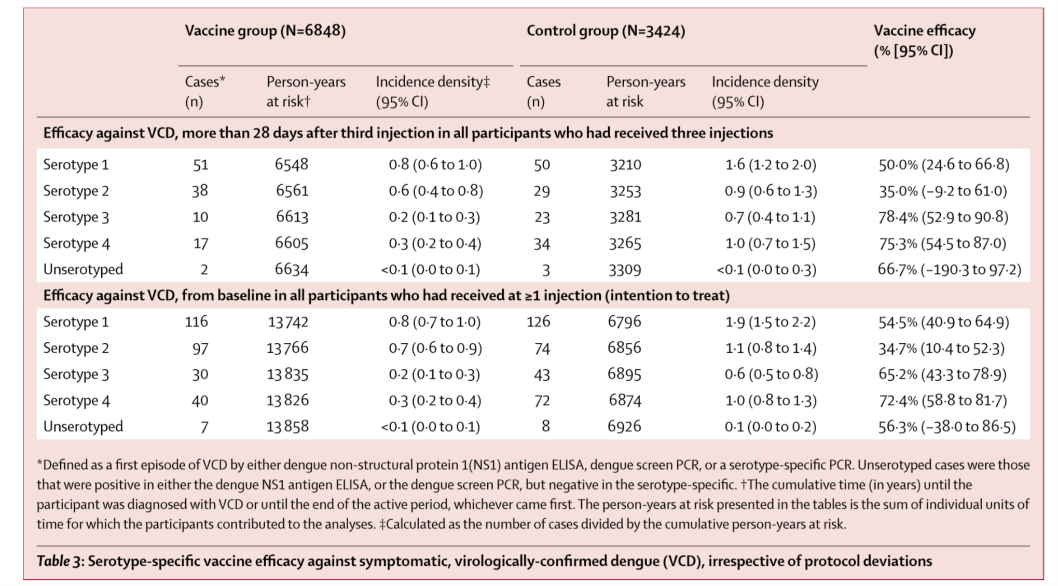
- サノフィが示した長期の有効性・安全性に関する報告(NEJM 2018;379:327)では、dengue-seropositiveな状態でワクチンを接種した者は少なくとも5年間はprotectされたとしている(全年齢(2-16歳)で重症dengue、入院を要したdengueが70%減少)。一方dengue-seronegativeな状態でワクチンを接種した者は、むしろリスクが増えた。(FigureはNEJM 2018;379:327より)
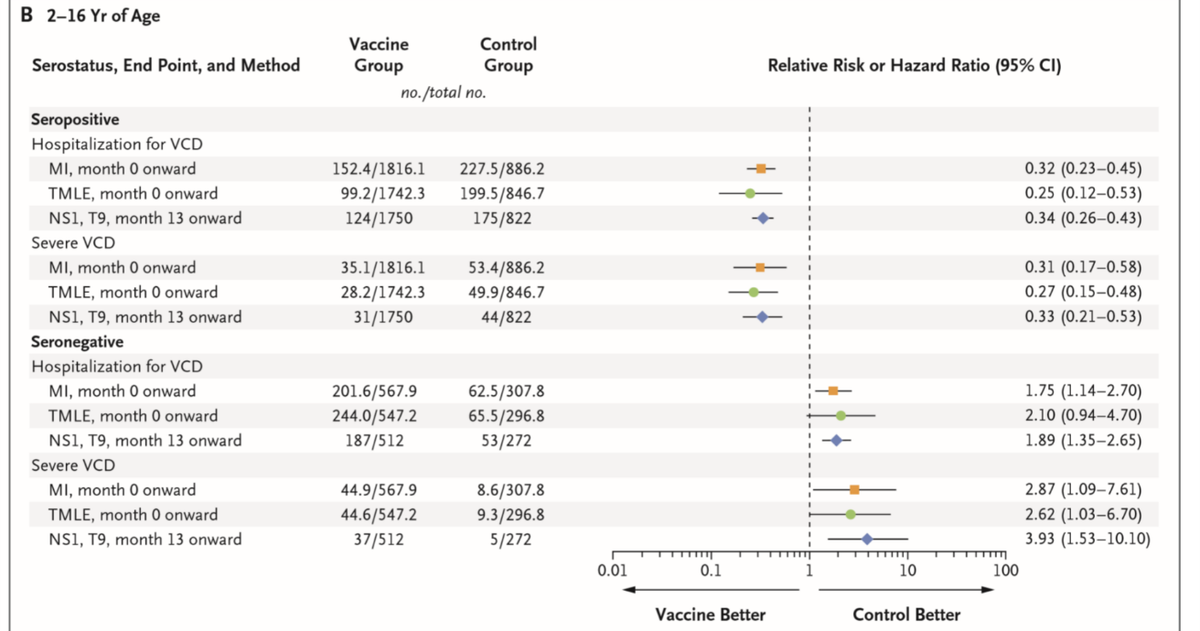
- ワクチンによって初めて免疫が賦活された患者が、デングに初回感染すると重症化しやすいという議論がある。海底されたWHO Strategic Advisory Group of Experts (SAGE)の推奨(Lancet Infect Dis 2019;19:e31)では、ワクチン接種前に検査し、seropositiveな人にだけ接種するのがpreferred strategyであるとされた。
- デングのserostatusの迅速検査開発が行われているが、他のフラビウイルスとの交差反応という問題がある。
- デングの非構造蛋白はサノフィのワクチンには含まれていないが、開発中の第二世代のワクチンには一部含まれる。現在新規のワクチンが2つphase 3で検討されており、一つはNational Institute of Allergy and Infections Diseases(TV003/TV005)、もう一つは武田(NCT02747927)である。これらも、seronegativeの人に打つとsevere dengueのリスクを上げるという懸念は残る。