感染性心内膜炎の内服スイッチ―NEJM 2019 POET trial
Partial Oral versus Intravenous Antibiotic Treatment of Endocarditis
Iversen K, et al. N Engl J Med 2019;380:415-24
POET trial
Abstract
- 左心系の感染性心内膜炎は通常6週間の静注抗菌薬投与を必要とする。治療途中に静注から内服抗菌薬に変更した場合に、静注のみで治療を完遂した場合と比較してefficacy、safetyが同等か議論がある。
- ランダム化、オープンラベル、非劣性、多施設共同。左心系心内膜炎(起因菌はレンサ球菌、E. faecalis、黄色ブドウ球菌、CNS)で、静注抗菌薬治療が開始されstableな状態となった患者400人を、①静注抗菌薬継続群(199人)と②経口抗菌薬に変更(201人)に分けた。可能なら、経口群は退院した。Primary outcomeは複合イベント(全死亡、予期しない心臓手術、塞栓症発症、当初の菌種による菌血症のrelapse)で、ランダム化から抗菌薬終了6ヶ月後まで観察した。
- 抗菌薬投与期間は①静注群で19日(IQR, 14-25)、②内服群で17日(IQR, 14-25)(p=.48)。primary outcomeは①静注群で24人(12.1%)、②内服群で18人(9.0%)(リスク差3.1%, 95%CI, -3.4-9.6; P=.40)。事前に設定した非劣性基準を満たした。
- 内服への変更は、静注群に対して非劣性である。
Introduction
- 左心系IEの治療期間は欧州のガイドライン(Eur Heart J 2015;36:3075)でも米国のガイドライン(Circulation 2015;132:1435)でもup to 6週と記載されている。院内死亡率は15-45%にもなり、弁手術を受ける患者も少なくない。死亡を含め合併症の多くは治療のinitial phaseで発生する。しかし初期治療が終わり安定すれば、静注治療を行うためだけに入院を継続することになる。内服薬への変更が安全ならば、早期に退院できる。
- outpatient parenteral treatmentは、条件を満たせば勧められるとガイドラインにも記載があるが、患者教育、アドヒアランス、入念なモニター、パラメディックおよび社会的サポート、医療機関へのアクセスといった様々な問題がある。この点で内服薬はメリットが大きい。
Methods
- デンマーク、多施設共同、ランダム化、非盲検、非劣性試験である。デザインはすでに公表されている(Am Heart J 2013;165:116)。Inclusion/exclusionは図。

- ランダム化時点で、抗菌薬投与残り期間が10日以上ある。静注群では治療完了まで入院、内服群はfeasibleなら退院し、週2-3回の外来通院とした。抗菌薬終了の1-3日以内に経食道心エコーを再検される。遅くとも抗菌薬終了日には全例退院してもらった。抗菌薬終了後、1週、1ヶ月、3ヶ月、6ヶ月後にフォローした。
- 抗菌薬はガイドラインに従って選択。内服薬はバイオアベイラビリティの高いもの2剤を選択し、EUCASTのMICから計算したdoseを投与。感受性試験はdisk diffusion法で行い、MICはEtestかVITEK2を使用。
- 内服群では初回投与後30分、1時間、2時間、4時間、6時間後の血中濃度、5日後の血中濃度をチェック。High-pressure liquid chromatographyを使用。血中濃度をみて必要なら投与量を変更した。
- 1:1に割付。
- Primary outcomeは複合イベント(全死亡、予期しない心臓手術、塞栓症発症、当初の菌種による菌血症のrelapse)で、ランダム化から抗菌薬終了6ヶ月後まで観察した。イベント発生の有無は割付群を知らされていない委員会が判断した。
- 非劣性。全死亡のリスクを2-5%、予期しない心臓手術を1-3%、塞栓症発症を1-2%、菌血症のrelapseを1-3%と見積もり、複合イベントのリスクを5-13%と考えた。非劣性を判断するリスク差は10%と設定。イベント発生を10%、フォローアップロスを5%、片側97.5%の信頼区間、検出率90%として、400人が必要と設定した。
Results
- 2011年7月15日から2017年8月30日。心内膜炎疑い患者1954人がスクリーニングされ、400人がランダム化。199人が静注群、201人が内服群。(Figure 1)
- 静注、内服の順で、年齢は平均67、67、女性が25%、20%、起因菌はレンサ52%、45%、faecalis 23%、25%、黄色ブドウ球菌20%、23%、CNS 5%、6%(内訳はTable S5)。人工弁26%、26%、ペースメーカー7%、10%、M弁32%、37%、A弁54%、54%、M+A弁11%、10%、vege>9mm 3%、5%、ランダム化前の手術37%、38%。
- IE診断からランダム化までの日数は両群とも17日。ランダム化後の抗菌薬使用は19、17日。内服群の80%で少なくとも1日以上の外来治療。
- Table S10に処方された内服抗菌薬、Figure S1にMIC。内服治療で開始したうち4人が静注へ変更(吐き気1、別の菌血症1、患者希望2)。静注から内服への変更はなし。
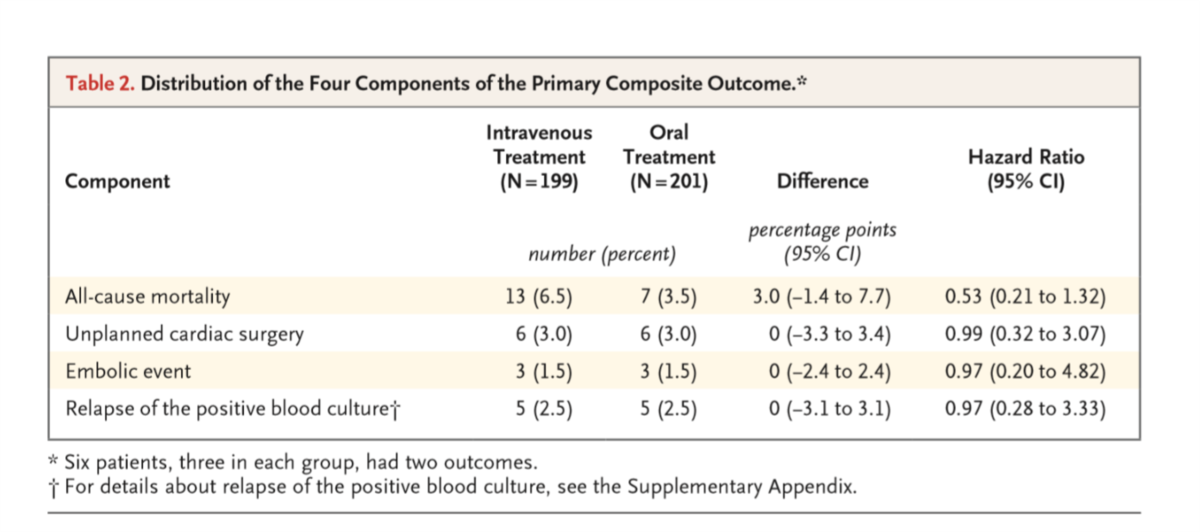
- primary outcomeは①静注群で24人(12.1%)、②内服群で18人(9.0%)(リスク差3.1%, 95%CI, -3.4~9.6; P=.40)。per-protocolでは静注群で12.1%、内服群で9.1%だった。すべての患者で抗菌薬終了6ヶ月後または死亡まで追跡された。
- ITTでの内訳は、全死亡が13人(6.5%)vs 7人(3.5%)で、ほかの項目はまったく同数だった。サブグループ解析も行っている。
- 内服群の7人で、2薬剤のうち1つについて十分な血中濃度が得られなかった。副作用は6%(6% vs 5%)にみられ、多いものはアレルギー(50%)、消化器症状(14%)などであった。
Discussion
- ちょうど治療の中間(17日)で静注から内服へ変更するのはsafety、efficacyとも問題なさそう。
- サブグループ(自然弁と人工弁、手術群と非手術群)でも結果は同等。菌種での違いも観察されなかった。アウトカム発生が多くなく(10%前後)、サブグループ内での検出率は十分でなかった。CNSでは死亡が多いようだが(40% vs 23%)、CNSのIEはより高齢、併存症が多い患者に起きやすいためと考える。
- 本研究は胃腸からの吸収が十分と考えられる患者しか登録していない。バイオアベイラビリティが高く、血中濃度も見ながら慎重に選択し、しかも2剤を用いている。
- IEの静注治療と治療期間は主に観察研究による(Med J Aust 1949;1:377、Circulation 1950;2:801)。長期間の入院は精神的・肉体的に負担となる。IE以外の分野では、例えば大腸手術後などの報告では短い入院期間でよいアウトカムが得られているし、コストもよい。
- いくつかの観察研究、システマティックレビュー(BMC Infect Dis 2014;14:140)ではIEの内服治療は有効と考えられている。右心系のIEでは症例によっては内服で治療できるという文献が多い。左心系では少なく、小規模の研究があるのみ(Am Heart J 2013;165:116)。
limitaions:
・左心系のIEのみ組み込んだが、デバイスや右心系IEの合併はあったかもしれない。
・菌種が限られている。今回含めた菌種以外の菌種はIE全体の25-30%を占める。培養陰性心内膜炎についても検討していない。
・IV drug userは5人だけ。
・黄色ブドウ球菌は22%であり、除外基準ではないがMRSAやその他の耐性株はいなかった。
・高齢でもともと虚弱な患者は参加施設に紹介されず、紹介バイアスがある。
・耐性菌の多い地域で、今回の結果を当てはめる場合には注意する。
・内服群の退院は患者希望や医師の判断によった。